技术资料
人们通常所遇到的物质除稀有气体外,都不是以单原子的形式出现,而是由原子与原子相互化合所形成的分子或晶体的形式出现。分子或晶体中的原子不是简单地堆砌在一起,而是存在着强烈的相互作用,化学上把这种分子或晶体中微粒(原子、离子或电子)间的相互作用力叫做化学键。本文着重介绍晶体的基本类型、金属晶体的三种紧密堆积、简述同素异构转变,以及合金的固溶体和金属化合物两种基本类型。
§1 晶体的基本类型
物质通常呈气、液、固三种聚集状态,固体又可分成晶体和非晶体两种,大多数固体物质是晶体。晶体在工程材料中占十分重要的地位。



黄铜矿 黄铁矿 石英
一、晶体和非晶体
晶体都具有固定的熔点,将晶体加热只有达到一定温度(熔点)时才开始融化,在没有全部融化以前,继续加热,温度不在上升,这时所供给的热量都用于使晶体从固态变为液态。
非晶体没有固定熔点,如玻璃、沥青、松香等,在加热过程中逐渐变软,开始流动,最后变成液体。金属因其晶体结构比较简单,很难阻止其结晶过程,故通常得不到非晶态固体,但采用特殊的制备方法可获得非晶态的金属和合金。而液态金属则几乎总是非晶体。
另外晶体的某些物理性质如解理(沿某一平面裂开现象)、光性质、导热性等,从不同方向去测定时常是不同的,晶体的这种性质叫各向异性。非晶体是各向同性的。晶体和非晶体所以有这些性质上的差异主要是由内部结构决定的。应用x射线研究晶体的结果表明,组成晶体的微粒(离子、原子或分子)有规则的、周期性的排列在空间的一定点上,这些点的总和叫晶格(或点阵)。而组成非晶体的微粒在空间的排列是不规则的。在晶格上排有微粒的那些点叫晶格的结点。


晶体有单晶和多晶的区别,由一个核心(称为晶核)生长而成的晶体称为单晶体。在单晶体中,原子都是按同一取向排列的。一些天然晶体如金刚石、水晶等都是单晶体;现在也能够人工培育制造出多种单晶体,如半导体工业用的单晶硅和锗。激光技术中用的红宝石和镱铝石榴石,以及金属或合金单晶等。但是金属材料通常是由许多不同位向的小晶体所组成,称为多晶体。

金属单晶体a)和多晶体b)结构示意图
这些小晶体往往呈颗粒状,不具有规则的外形,故称为晶粒。晶粒与晶粒之间的界面称为晶界(晶界是单晶体区别与多晶体的主要特征)。下图为纯铁的显微组织,可看到晶粒和晶界。
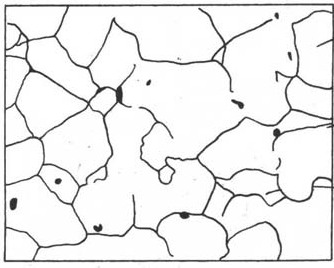
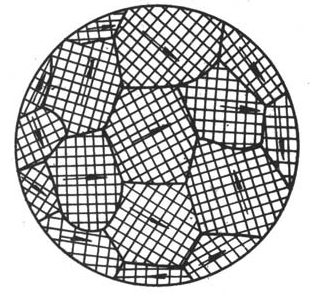
工业纯铁的显微镜组织 各晶粒位向示意图
多晶体材料一般不显示出各向异性,这是因为它包含大量的彼此位向不同的晶粒,虽然每个晶粒有异向性,但整块金属的性能则是它们性能的平均值,故表现为各向同性,这种情况称为伪各向同性或假等向性。在某些条件下,如定向凝固、特定的轧制退火等,使各晶粒的位向趋于一致。则其异向性又会显示出来。
二、四种基本晶体
按照晶格结点上微粒间作用力的性质,可将晶体分成以下四种基本类型:
1.离子晶体
 食盐晶簇
食盐晶簇
在离子晶体的晶格结点上交替地排列着正离子和负离子。在正、负离子间有静电引力(离子键)作用着。如:氯化钠。属于离子晶体的物质通常有活波金属的盐类和氧化物。离子晶体的特性是有较大的硬度与熔点,延性和展性很小,熔融后能导电,很多离子晶体易溶于极性溶剂如水中。
2.原子晶体
 金刚石
金刚石
在原子晶体的晶格结点上排列着原子,原子之间有共价键联系着。属于原子晶体的物质,单质中除金刚石外,还有可做半导体元件的单硅和鍺。在化合物中如碳化硅、砷化镓、二氧化硅等也是原子晶体。原子晶体的延性和展性很小。由于晶体中没有离子,固态、融融态都不易导电。但是,某些原子晶体如Si、Ge等还是可以作为优良的半导体材料。
3.分子晶体
在分子晶体的晶格结点上排列着分子,在分子之间有分子间力作用着。许多非金属单质、非金属元素所组成的化合物以及绝大部分的有机化合物,都能形成分子晶体。由于分子间力较弱,分子晶体的硬度较小,熔点较低。分子晶体是由电中性的分子组成的,固态和熔融态都不导电。例:二氧化碳属分子晶体(俗名干冰),晶格结点上排列着CO2分子,-79℃时即升华。
4.金属晶体
在金属晶体的晶格结点上排列着原子和正离子,在这些离子、原子之间,存在着从金属原子脱落下来的电子。这些电子不是固定在某一离子的附近,而是在整个晶体中自由地运动,叫做自由电子。当电子从原子脱落下来时,原子就变成正离子,但当电子与正离子结合时,又变成了原子。由于自由电子的运动而引起金属晶体中微粒间的联结叫做金属键。
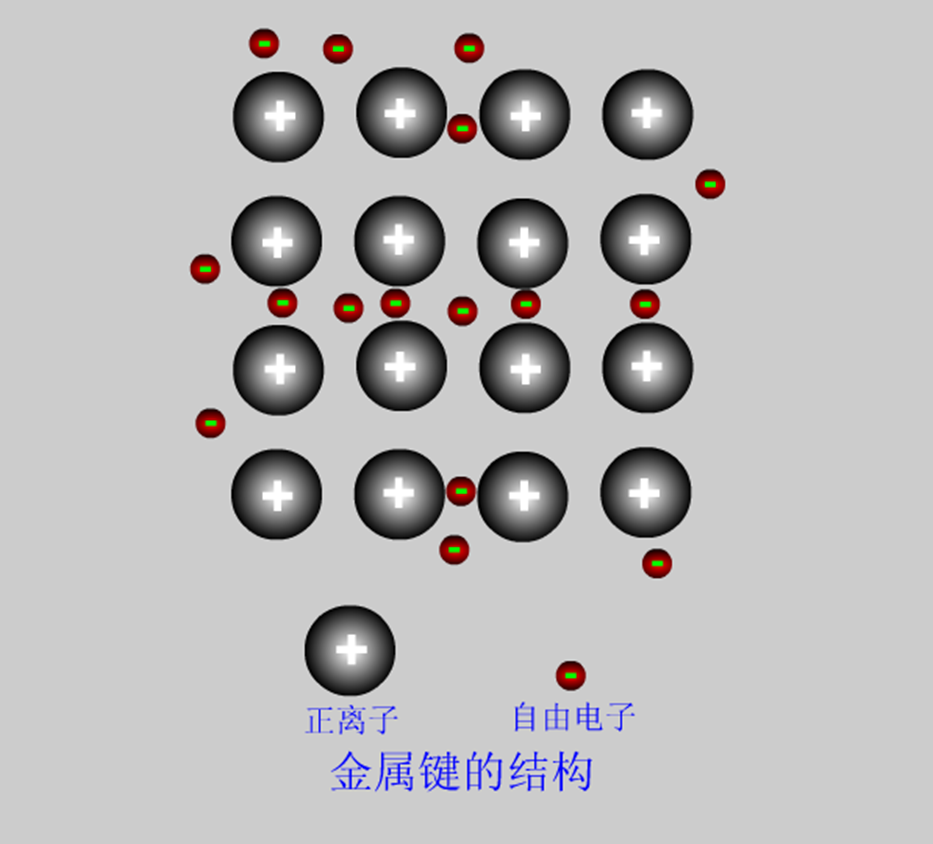 |
当大量金属原子结合在一起构成金属晶体时,金属原子失去外层电子变成正离子;失去的外层电子为自由电子,为整个金属所共有,构成电子云,金属正离子在其平衡位置作高频率的热振动;金属离子和自由电子之间的引力与离子间和电子间的斥力相平衡,从而构成稳定的金属晶体。这种结合方式(化学键)称之为金属键。金属键的强弱决定金属的熔沸点、硬度、弹性模量等物理性质。 |
| 金属键——电子云 | |
金属具有不透明性,一般有银白色或灰色的金属光泽(金呈黄色、铜呈紫红色属于例外),是电和热的良导体,导电性随温度的升高而降低,金属具有优良的机械加工性能如延性和展性等。金属的这些通性可从金属键的自由电子理论得到大致的说明:
A.自由电子在电场的作用下定向运动形成电流,从而显示出良好的导电性。
B.随着温度升高,正离子振动的振幅要加大,对自由电子通过的阻碍作用也加大,因而,金属的电阻是随温度的升高而增加的,即具有正的电阻温度系数。
C.自由电子的运动和正离子的振动可以传递热能,因而使金属具有较好的导热性。
D.当金属发生塑性变形后,正离子与自由离子间所能保持金属键的结合,使金属显示出良好的塑性。
E.自由电子能吸收可见光的能量,故金属具有不透明性。吸收能量后跳到较高能级的电子,当它重新跳回到原来低能级时,就把所吸收的可见光的能量以电磁波的形式辐射出来,在宏观上就表示为金属的光泽。
5.除了上述四种基本类型的晶体以外,还有一些过度型的晶体:
链状结构的晶体:石棉等(略)
层状结构的晶体:石墨晶体和金刚石晶体虽然都是由碳元素所组成的,但石墨的晶体结构和金刚石不同,具有正六角的平面层状结构。具有导电、导热性,在工业上用作石墨电极和石墨冷却器。又层与层之间引力较弱,与分子间力大小相仿,容易滑动,工业上常用作固体润滑剂。象石墨和金刚石这类由相同元素组成而晶体结构不同的物质叫做同素异形体或同素异晶体。
§2 金属晶体的紧密堆积与合金基本类型
在已发现的元素中,金属元素近3/4左右。同时金属材料在工程材料中占特殊重要的地位,因此在已介绍的四种基本晶体类型的基础上,继续对金属晶体中的金属原子的堆积和合金的基本类型进行讨论。
一、金属晶体的紧密堆积
构成金属单质的金属原子,沉浸在快速运动的电子云雾中,整个金属原子可看作具有一定体积的等径圆球。所以金属键没有方向性和饱和性。大多数金属晶体中的原子和离子常采取最紧密堆积的方式。而使晶体趋于稳定。常见的紧密堆积方式有三种:
1.面心立方晶格FCC (face-centered cubic)
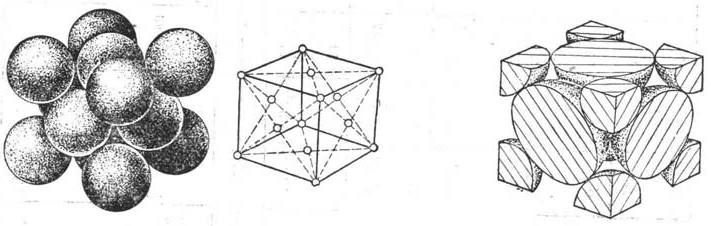
(a)刚球模型 (b) 质点模型 (c) 单位晶胞原子数
图1面心立方结构的单位晶胞
每个金属原子有12个近邻原子,即配位数为12,空间利用率达74.02%,有较多可以滑动的平面,具有这种晶格的金属,延展性好。属于这种金属晶格的金属单质晶体有:γ-Fe、Al、Ca、Sr、β-Co、Ni、Rh、Pb、Pt、Cu、Ag、Au、Pb等。
2.密集六方晶格HCP (hexagonal close packed)
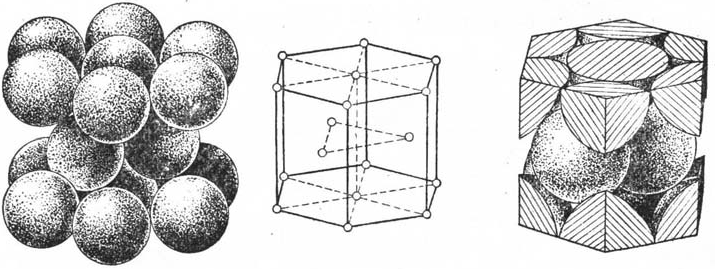
(a)刚球模型 (b) 质点模型 (c) 单位晶胞原子数
图2密排六方结构的单位晶胞
金属原子的配位数也是12,空间利用率也可达74.02%,属于这种金属晶格的金属单质晶体有:a-Ti、a-Co、Zn、Be、Mg、Cd等。
3.体心立方晶格BCC (body-centered cubic)

(a)刚球模型 (b) 质点模型 (c) 单位晶胞原子数
图3体心立方结构的单位晶胞
紧密程度不及前两种金属晶格,金属原子的配位数是8,空间利用率为68.02%,属于这种金属晶格的金属单质晶体有:a –Fe、β-Ti 、Cr、W、V、Mo、Li、Na、K等。
4.同素异晶转变
在周期表中,大约有40多种元素具有两种或两种类型以上的晶体结构。当外界条件主要指温度和压力改变时,元素的晶体结构可以发生转变,把金属的这种性质称为多晶型性。这种转变称为多晶型转变或同素异构转变。
例如:纯铁
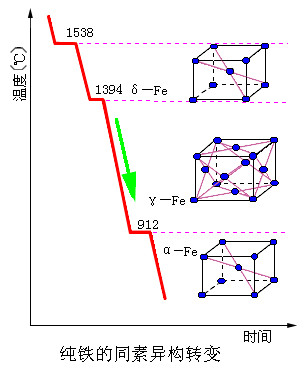 |
铁在912℃以下为体心立方结构,称为α—Fe; 在912~1394℃之间为面心立方结构,称为γ—Fe; 当温度超过1394℃时,又变为体心立方结构,称为δ—Fe; 在高压下(150kPa) 铁还可以具有密排六方结构,称为ε—Fe。 |
锡在温度低于18℃时为金刚石结构的α锡,也称为“灰锡”;而在温度高于18℃时为正方结构的β锡,也称为“白锡”。碳具有六方结构和金刚石结构两种晶型。具有多晶型性的其他金属还有Mn、Ti、Co、Sn、Zr等。当晶体结构改变时,金属的性能如体积、强度、塑性、磁性、导电性等往往要发生突变。钢铁材料之所以能通过热处理来改变性能,原因之一就是因其具有多晶型转变。
二、合金的基本类型
纯金属的性能常常不能满足各方面的生产需要,以强度为例,纯金属的强度一般都很低,如铁的拉伸强度约为200MN/m2,而铝还不到100 MN/m2,显然都不适合用作结构材料。如何改变和提高金属材料的性能?实践证明,合金化是最主要的途径。所以通常使用的金属材料大多是合金。合金是由两种或两种以上的金属(有时为非金属)共熔后所形成的物质。例如,常用的碳素钢是铁碳合金,不锈钢是铁、铬、(镍)合金,黄铜是铜、锌合金等。
1.合金与相
组成合金的最基本的、独立的物质称为组元,或简称为元。一般来说,组元就是组成合金的元素,黄铜的组元是铜和锌,铁碳合金的组元是铁和碳。由两个组元组成的合金称为二元合金,由三个组元组成的合金称为三元合金,由三个以上组元组成的合金则称为多元合金。由给定组元可以配制成一系列成分不同的合金,这些合金组成一个合金系统,称为合金系,两个组元组成的为二元系,三个组元组成的为三元系,更多组元组成的称为多元系。
所谓相是指金属或合金中具有同一聚集状态、同一结构和性质,并与其它部分有明显界面分开的均匀组成部分。合金在固态下可以形成均匀的单相合金,也可能是由几种不同的相所组成的多相合金。合金相只有在显微镜下才能观察到,在显微镜下看到的内部组织结构称为显微组织或金相组织。当外界条件不变时,这种组织状态不随时间而变化。
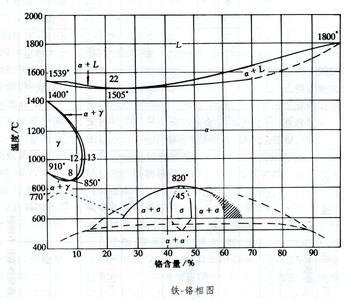 |
相图是金属或合金在一定条件下所呈现相应均一组态和性质的聚集体的图。是研究金属和合金的成分、组织和性能的关系的基础。新合金成分的配制和设计,已有合金性能的提高(如Fe-Cr合金中避免出现脆性的σ相)均需参考相图。相图也为金属热处理、铸造、塑性加工和焊接等工艺提供了必要的指导性知识。 |
2.合金的晶体结构
在液态下,大多数合金的组元均能相互溶解,成为均匀的液体,因而只具有一个液相。在凝固后,由于各组元的晶体结构、原子结构等不同,各组元间的相互作用不同,在固态合金中可能出现不同的相结构,合金按照晶体结构的不同,主要有固溶体和金属化合物两大类。
A. 固溶体
以一种金属为溶剂,另一种金属或非金属作为溶质,共熔后所形成的固态溶液,叫做固溶体。固溶体保持着溶剂金属的晶格类型,而溶质原子则分布在溶剂金属的晶格中。根据溶质原子在溶剂晶格中的位置不同,还可再分成下列两种固溶体:
A-1. 置换固溶体
溶剂晶格上的部分原子被溶质原子所置换的固溶体。当金属的电子层结构、原子半径和晶格类型等因素越接近时,越容易相互溶解。例如,Cu和Ag、a-Fe和Cr、r-Fe和Ni等都能无限互溶,因为他们各方面的性质都比较接近。
、
|
|
溶剂原子 溶剂原子
|
置换固溶体示意图
A-2. 间隙固溶体
是在溶剂晶格的间隙填入溶质原子而形成的固溶体。和置换固溶体不同,只有溶质原子半径远小于溶剂原子半径的元素如,C、N、B、H等元素才能形成。C在r-Fe中的溶解度比在a-Fe中大得多,虽然面心晶格中原子的堆积比体心晶格紧密,但在晶格的中心位置有一个较大的间隙,所以钢的渗碳必需加热到r-Fe的状态时进行。
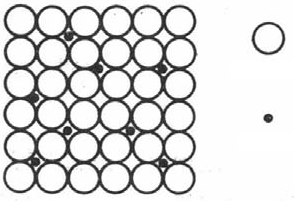 |
溶剂原子 溶质原子 |
| 间隙固溶体示意图 |
不论是形成置换固溶体或间隙固溶体,溶剂金属的晶格虽然保持不变,但总会产生一定程度的变形,增强了抵抗外力的影响,所以固溶体的抗张强度和硬度都比纯金属要高。
B. 金属化合物
当形成合金的元素其电子层结构、原子半径和晶体类型相差较大时,易形成金属化合物。金属化合物的晶格类型不同于它的组分金属,自成新相,这是和固溶体不同的地方。金属化合物有好多种类,但主要可分成下列三种:
B-1. 正常价化合物
这类化合物是由电负性相差较大的元素所组成,其组成符合化合价的规则如Mg2Pb等,但工业价值不大。
B-2. 间隙化合物
原子半径较小的非金属元素除能与过渡金属形成间隙固溶体以外,还能形成晶格类型和过渡金属不同的间隙化合物。例如,工程上的硬质合金WC等就是这一类化合物。它们的组成并不符合化合价规则,并在一定范围内可发生变化。
B-3. 电子化合物
主要是由Cu、Ag、Au、Fe、Co、Ni、Pt、Pb等元素和Be、Zn、Cd、Al、Sn、Si等元素之间所形成的合金。这种化合物多存在于有色金属(冶金学中把铁、锰、铬这三种金属元素叫做黑色金属。其余金属元素,除人造放射性金属外,叫有色金属。)的合金中。其组成也不存在化合价规则,并可在一定范围内发生变化。但它们的晶格类型还是和化合物中原子的价电子数和原子数的比值有关,所以叫做电子化合物。
例如:β-黄铜(Cu-Zn)其组分原子的价电子数与原子数的比值为3/2或21/14,具有体心立方晶格。r-黄铜(Cu5Zn8)中的比值是21/13,具有复杂立方晶格,ε-黄铜(CuZn3)中的比值是7/4或21/12,具有密集六方晶格。
金属化合物不仅在晶体结构上不同于组分金属,而且性质上也不同。通常熔点更高、硬度和脆性也更大,但仍能导电、导热(比组分金属低),具有金属的性质,所以叫做金属化合物,以区别于一般的化合物。
合金的上述二种基本类型,它们都是均匀的合金结构,但当熔融的合金凝固时,也可以得到各组分互不相溶、互不化合的机械混合物。这种混合物不仅存在于纯金属之间,而且在纯金属、固溶体和金属化合物之间都可以形成。
晶体结构
版权所有©天津市斯坦利不锈钢加工有限公司 津ICP备12006174号-1 技术支持:云梦网络 


